Seguridad Tecnología médica La seguridad como máxima
Gestión de riesgos según DIN EN ISO 14971
La seguridad de los pacientes, médicos y enfermeras es de gran importancia para Interelectronix .
Al introducir un sistema de gestión de riesgos para dispositivos médicos de acuerdo con DIN EN ISO 14971, estamos más que a la altura de nuestra máxima.
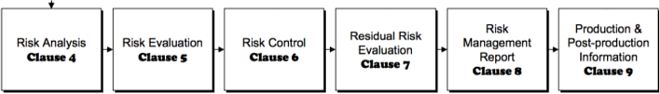
Independientemente de las regulaciones legales, la aplicación de la gestión de riesgos desde la idea del producto hasta el lanzamiento al mercado se practica consistentemente en Interelectronix en todos los procesos y departamentos e incluye los siguientes componentes:
-Análisis del riesgo
-Evaluación de riesgos
- Control de riesgos
- Análisis de información relevante para el riesgo a partir de la observación del mercado
- Evaluación de las lecciones aprendidas del proceso de gestión de riesgos
Un elemento importante de nuestra gestión de riesgos es una reevaluación periódica de todas las medidas después de que se hayan implementado. Sin embargo, esto no termina con la entrega de un producto, sino que incluye específicamente la observación del mercado del producto a lo largo de sus fases de ciclo de vida.
Si es necesario, se lleva a cabo un ajuste dinámico de la gestión de riesgos para los productos sanitarios mediante una estrecha observación de los productos y sus funciones en uso, teniendo en cuenta los respectivos tipos de peligro.
Los productos de tecnología médica deben ser seguros y eficientes de usar. En consecuencia, es lógico aplicar la gestión de riesgos ya en la fase de desarrollo.
El objetivo principal de Interelectronix gestión de riesgos es, por lo tanto, garantizar la eliminación o minimización de los riesgos a través de medidas conceptuales o constructivas.
Esto comienza con el diseño de un producto y se extiende a todos los procesos, procedimientos y procedimientos de producción.
El análisis de riesgos es una parte importante de la gestión de riesgos
La realización de un análisis de riesgos es requerida por los procedimientos de aprobación en la UE y por la FDA. Es una forma eficiente de dirigir los esfuerzos de desarrollo y validación de productos a donde pueden surgir los mayores riesgos.
El análisis de modo y efectos de falla (FMEA) ha sido hasta ahora un componente esencial de la garantía de calidad antes del inicio de la producción en serie. Sin embargo, los análisis de riesgo según DIN EN ISO 14971 difieren considerablemente de FMEA.
Por lo tanto, el modo de fallo y el análisis de efectos ya no son reconocidos por los organismos de aprobación para la aprobación de dispositivos según EN 60601-1 3ª edición.
MOPP - Medios de Protección al Paciente
La norma IEC 60601-1 define "Medios de protección del paciente (MOPP) para reducir el riesgo de descarga eléctrica para el paciente".
Como resultado, los dispositivos médicos siempre deben estar equipados con dos medidas de protección independientes para la protección del paciente con el fin de ser "primero a prueba de fallos".
Si una de las dos medidas de protección falla, la seguridad del paciente no debe verse comprometida. Dependiendo del tipo de peligro, varios sistemas de protección suelen trabajar uno al lado del otro, que están destinados a contrarrestar diferentes potenciales de peligro.
-Resistencia dieléctrica
Una alta resistencia dieléctrica está destinada a proteger contra las sobretensiones pulsadas que ocurren con frecuencia en los sistemas eléctricos.
Estructura de aislamiento específica de la aplicación
Una estructura de aislamiento específica de la aplicación está destinada a prevenir el riesgo de aislamiento inadecuado debido a defectos de fabricación o al proceso de envejecimiento.Distancias de despeje y fuga
Los ambientes húmedos o polvorientos pueden provocar flashovers eléctricos, que deben evitarse mediante distancias de despeje y fuga.Corrientes de fuga - corrientes de fuga
Los pacientes deben protegerse de las corrientes de fuga que actúan reduciéndolas a los valores máximos de las corrientes de fuga (el estándar depende del dispositivo).- Conexiones conductoras protectoras *
Las conexiones conductoras de protección están diseñadas para disipar corrientes peligrosas para que no lleguen al paciente.
- Conexiones conductoras protectoras *
Corriente de fuga del paciente (DIN 60479-1)
La corriente de fuga del paciente es creada por un circuito eléctrico sin fallas en el dispositivo, que fluye directamente a través del conductor de protección o indirectamente como una corriente de fuga del dispositivo a través de las partes del dispositivo conductor a tierra, lo que representa un peligro para los pacientes.
Sistemas táctiles y HMI según norma IEC/UL 60601-1
Especialmente en tecnología médica, la seguridad del dispositivo, la protección personal, la alta higiene, la larga vida útil, la fiabilidad y la integración funcional eficiente son de suma importancia. Todos los paneles táctiles y sistemas táctiles desarrollados por Interelectronix están sujetos a los altos requisitos de seguridad para dispositivos médicos de acuerdo con la norma básica IEC/UL 60601-1.
La norma IEC/UL 60601-1 define los requisitos generales para las características básicas de seguridad y rendimiento esencial de los sistemas eléctricos médicos conectados a una red de suministro destinados al diagnóstico, tratamiento o monitorización de un paciente. La norma europea EN 60601-1 es idéntica a la norma IEC/UL 60601-1.
Debido a su alta fiabilidad y tecnología avanzada, su innovador diseño de producto y su usabilidad intuitiva, los sistemas táctiles Interlecronix son utilizados por
- Dispositivos ultrasónicos
- Máquinas de rayos X
- Tomografía computarizada
- Equipos de análisis de laboratorio
así como
- en el quirófano
- en medicina dental
- en la monitorización del paciente
- y registro de pacientes
usado.
En el caso de las pantallas táctiles utilizadas en tecnología médica, la corriente de fuga del paciente puede evitarse mediante un diseño específico, aislamiento o el uso de materiales adecuados, como carcasas de plástico o paneles frontales.
Cada panel táctil utilizado en tecnología médica está sujeto a una verificación precisa del flujo de corriente exacto para detectar y evitar la corriente de fuga del dispositivo.
Pruebas de protección según IPX1 a IPX8
Las pantallas táctiles de los dispositivos médicos están sujetas a requisitos de seguridad especialmente elevados. Por ejemplo, los sistemas táctiles a menudo tienen que trabajar sin errores durante años en condiciones difíciles y, al mismo tiempo, garantizar una protección total para los pacientes y el personal operativo.
Las pantallas táctiles utilizadas en la tecnología médica están sujetas a una exposición considerable a agentes de limpieza, desinfectantes, agua, vapores, ácidos o fluidos corporales. Además, la entrada de cuerpos extraños y polvo, así como la contaminación con bacterias y virus, deben eliminarse virtualmente.
De acuerdo con los respectivos requisitos y áreas de aplicación, Interelectronix desarrolla sistemas táctiles listos para instalar que cumplen con las diversas clases y estándares de protección desde IPX1 hasta IPX8:
- Protección contra cuerpos extraños (DIN 40 050 Parte 9 o DIN EN 60529)
- Protección contra el agua (DIN 40 050 Parte 9 o DIN EN 60529, pruebas de clase de protección contra el agua)
- Resistencia a los golpes (DIN EN 62262)
Como especialista en sistemas táctiles de alta calidad y listos para instalar, Interelectronix tiene muchos años de experiencia en el desarrollo de pantallas táctiles, paneles táctiles y sistemas táctiles completos que cumplen con los requisitos especiales de la tecnología médica para la seguridad, durabilidad y protección del paciente.
Una amplia gama de vidrios, materiales de carcasa, sellos de alta calidad y técnicas de laminación permiten la construcción de HMI (interfaz hombre-máquina) compatible con IPX1 a IPX8.